Unos científicos reportaron el 11 de septiembre que un innovador tratamiento contra el cáncer también puede curar ciertos tipos de insuficiencia cardiaca en ratones.
El tratamiento es un tipo de inmunoterapia conocida como CAR-T, que ha demostrado cambiar la vida de algunos pacientes con leucemia. Este tratamiento se basa en linfocitos diseñados (linfocitos T) que buscan y destruyen células malignas en el cuerpo.
En el nuevo estudio, publicado en la revista Nature, se utilizó la tecnología para atacar el tejido cicatricial que endurece al corazón y evita que se relaje por completo entre latidos en pacientes que tienen insuficiencia cardiaca.
“Se trata de un ensayo que podría significar un gran avance”, comentó Richard Lee, profesor de Biología Regenerativa y Células Madre en la Universidad de Harvard, que no participó en el nuevo estudio.
Los expertos en medicina como Lee coinciden en que el estudio es inteligente e innovador y representa al menos un estudio preliminar de eficacia. Sin embargo, algunas personas preguntaron si sería factible usar la terapia para atender a pacientes con enfermedades cardiacas, al menos en un futuro cercano.
La terapia CAR-T para el cáncer tiene un costo aproximado de 450.000 dólares por paciente. Cuando hay que incluir la estancia en el hospital, el precio puede rondar el millón de dólares o más.
En Estados Unidos existen seis millones de pacientes con insuficiencia cardiaca; incluso si se ofreciera el tratamiento a ese precio a solo unos cuantos de ellos, el costo general sería estratosférico.
Algunos pacientes que reciben terapia CAR-T presentan efectos secundarios graves e incluso mortales, incluyendo fiebres muy altas, presión sanguínea demasiado baja y secuelas en el cerebro como confusión o convulsiones.
Utilizar la terapia CAR-T para tratar la insuficiencia cardiaca “es una idea muy inteligente”, comentó Douglas Mann, un profesor de Medicina en la Universidad Washington en Saint Louis; sin embargo, añadió que, debido al costo de la CAR-T y a los efectos secundarios, no es práctico hacerlo actualmente.
Cuando hay insuficiencia cardiaca, las paredes de los ventrículos, las dos grandes cámaras de bombeo, se endurecen y pueden crecer, evitando que el corazón bombee la sangre de manera eficiente por todo el cuerpo. Eso puede derivar en muchas enfermedades como infartos y presión alta.
Aunque muchos pacientes responden a la terapia con medicamentos, aquellos que padecen insuficiencia cardiaca con fracción de eyección conservada tienen muy pocas opciones de tratamiento. La mitad muere al cabo de cinco años, un índice de mortalidad comparable con el de algunos cánceres metastásicos.
Lee recalcó que la insuficiencia cardiaca es un problema particular de las personas con distrofia muscular. La insuficiencia cardiaca, dijo, “es una parte de la enfermedad que limita la vida en gran medida”.
El músculo cardiaco se endurece debido a las cicatrices, a lo cual también se le conoce como fibrosis, afirmó Jonathan Epstein, autor principal del nuevo estudio y profesor de investigación cardiovascular en la Facultad de Medicina Perelman de la Universidad de Pensilvania.
La fibrosis se presenta en un amplio rango de enfermedades: artritis, nefropatía crónica y cirrosis hepática, por ejemplo. Es producto de la respuesta del cuerpo a la inflamación. Aunque la fibrosis es responsable de la mayoría de los peores síntomas de estas enfermedades, no está claro qué efecto podría tener el tratamiento para la fibrosis.
La idea del estudio surgió con Haig Aghajanian, un estudiante de posdoctorado en el laboratorio de Epstein. El estudiante se preguntó: “¿Por qué no podemos crear una terapia CAR-T para eliminar el tejido cicatricial en el corazón?”.
Él sabía cómo funciona la terapia CAR-T con el cáncer. Los linfocitos T del sistema inmunitario están recorriendo el cuerpo constantemente, en busca de células solitarias a las que puedan adherirse y matar. En ocasiones, los linfocitos T no reconocen a las células cancerígenas, pero los investigadores han hallado una manera de resolverlo.
Adhieren una proteína a los linfocitos T diseñada para seguir y engancharse en las células cancerígenas. Cuando esos linfocitos T manipulados pasan cerca de una célula cancerígena, se aferran a ella hasta matarla.
El tratamiento puede funcionar, siempre y cuando, la mayor parte de las células sanas no tengan el espacio de anclaje para la proteína del linfocito T.
“Es emocionante”, afirmó Elizabeth McNally, una cardióloga y genetista humana de la Facultad de Medicina Feinberg de la Universidad Northwestern. No obstante, advirtió, hay muchas preocupaciones potenciales para cualquier terapia que ataque a los fibroblastos.
Son células que ayudan a formar todos los tejidos y tienen un papel relevante en la sanación de las heridas. Un tratamiento ideal no debería eliminar la fibrosis de todo el cuerpo, sino únicamente las cicatrices que merman el funcionamiento normal.
Hasta ahora, Epstein y sus colegas no han identificado problemas con la sanación de las heridas o el funcionamiento normal en sus animales de estudio, pero el trabajo aún es experimental y preliminar.
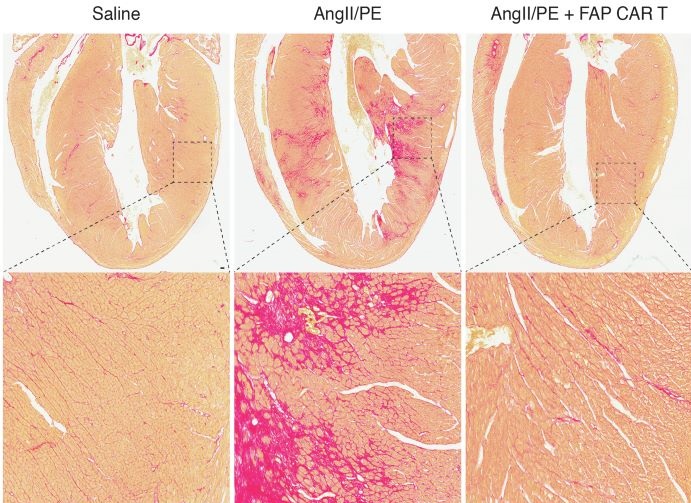
Aghajanian y Epstein comenzaron por colocar un sitio de anclaje en células de tejido cicatricial en el corazón de los ratones con insuficiencia cardiaca. Luego hicieron que las células CAR-T se anclaran en esos lugares.
Dos semanas después de que los ratones fueron tratados, Aghajanian le llevó algunos portaobjetos a Epstein. Ambos se sentaron lado a lado a observarlos bajo el microscopio. El tejido cardiaco de los ratones que no recibieron tratamiento estaba lleno de cicatrices. El tejido cardiaco de los ratones que recibieron tratamiento estaba limpio.
“Fue uno de esos momentos reveladores”, dijo Epstein. “Nos miramos uno al otro y chocamos las manos sobre el microscopio”.
El siguiente paso consistió en buscar una proteína natural que estuviera presente en las células de la fibrosis humana, pero no en otras células. Buscando en una extensa base de datos genética, el grupo descubrió una: la proteína de activación de fibroblastos (FAP).
Los científicos descubrieron que los ratones y otros animales también tienen la FAP en células de tejido cicatricial, así que programaron a las células CAR-T para buscar la proteína. El tratamiento funcionó para eliminar tejido cicatricial en el corazón de los ratones y al parecer no dañó otros tejidos.
Ahora los investigadores han comenzado a repetir el experimento en perros.
“Espero que pronto podamos dar el paso a los humanos”, dijo Epstein, y señaló que un grupo en Alemania ha descubierto una manera de analizar el corazón de los pacientes que han padecido infartos y detectar la FAP.
Eso permitiría a los médicos saber rápidamente si los pacientes son candidatos al tratamiento CAR-T.
En cuanto al costo, él considera que se reducirá. “Por lo general, las curas de primera generación son costosas”, explicó Epstein, pero “el éxito y la demanda impulsan la innovación”.
Jeffery D. Molkentin, codirector ejecutivo del instituto del corazón en el Cincinnati Children’s Hospital Medical Center, también se muestra optimista respecto a que los obstáculos se pueden superar.
“Podría ser transformador”, dijo.
“Toda esta idea de los linfocitos T manipulados para atacar al cáncer es solo la punta del iceberg”, añadió. “¿Qué pasaría si pudiéramos manipular linfocitos T para atacar a todas las células del cuerpo que ocasionen problemas?”.
Gina Colata escribe acerca de ciencia y medicina. Ha sido finalista del premio Pulitzer en dos ocasiones y es autora de seis libros, incluyendo Mercies in Disguise: A Story of Hope, a Family’s Genetic Destiny, and The Science That Saved Them. @ginakolata Facebook