Kenneth Koncilja, geriatra de la Clínica Cleveland, vio el anuncio de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por su sigla en inglés) el 7 de junio, en Twitter: la agencia había aprobado Aduhelm (aducanumab), el primer medicamento para tratar la enfermedad de Alzheimer que se aprueba en casi 20 años.
Las llamadas de los cónyuges y familiares de los pacientes comenzaron una hora después del anuncio y no han parado.
“Me sorprendió la rapidez con la que se corrió la voz: ‘Oye, ¿lo podemos utilizar? ¿Cuándo podemos conseguirlo?”, recordó Koncilja. “Hay una mezcla de emoción, ansiedad y desesperación”.
La primera llamada que recibió esa mañana fue de Joan Morehouse, de 78 años, quien ha estado cuidando a su esposo James, de 71, en su casa de North Perry, Ohio, desde que le diagnosticaron alzhéimer hace cuatro años. Ella lo ha visto perderse en trayectos familiares y olvidar los nombres de sus nietos.
Morehouse recordó que, cuando su hermano y su hijo le enviaron por correo electrónico un artículo sobre la acción de la FDA, pensó: “Dios mío, mis oraciones han sido escuchadas”.
A Koncilja le tocó explicarle las complejidades: que el medicamento Aduhelm aún no está disponible; que aún no se han desarrollado los protocolos que determinan qué pacientes cumplen los requisitos; que los datos de los ensayos clínicos son ambiguos y que es probable que el fármaco no aporte mejoras notables en la vida cotidiana; además de que entre sus efectos secundarios se encuentran la inflamación y hemorragia cerebral.
Asimismo, su fabricante, Biogen, calcula que el costo anual de las infusiones intravenosas mensuales es de 56.000 dólares, además de costosas tomografías y análisis.
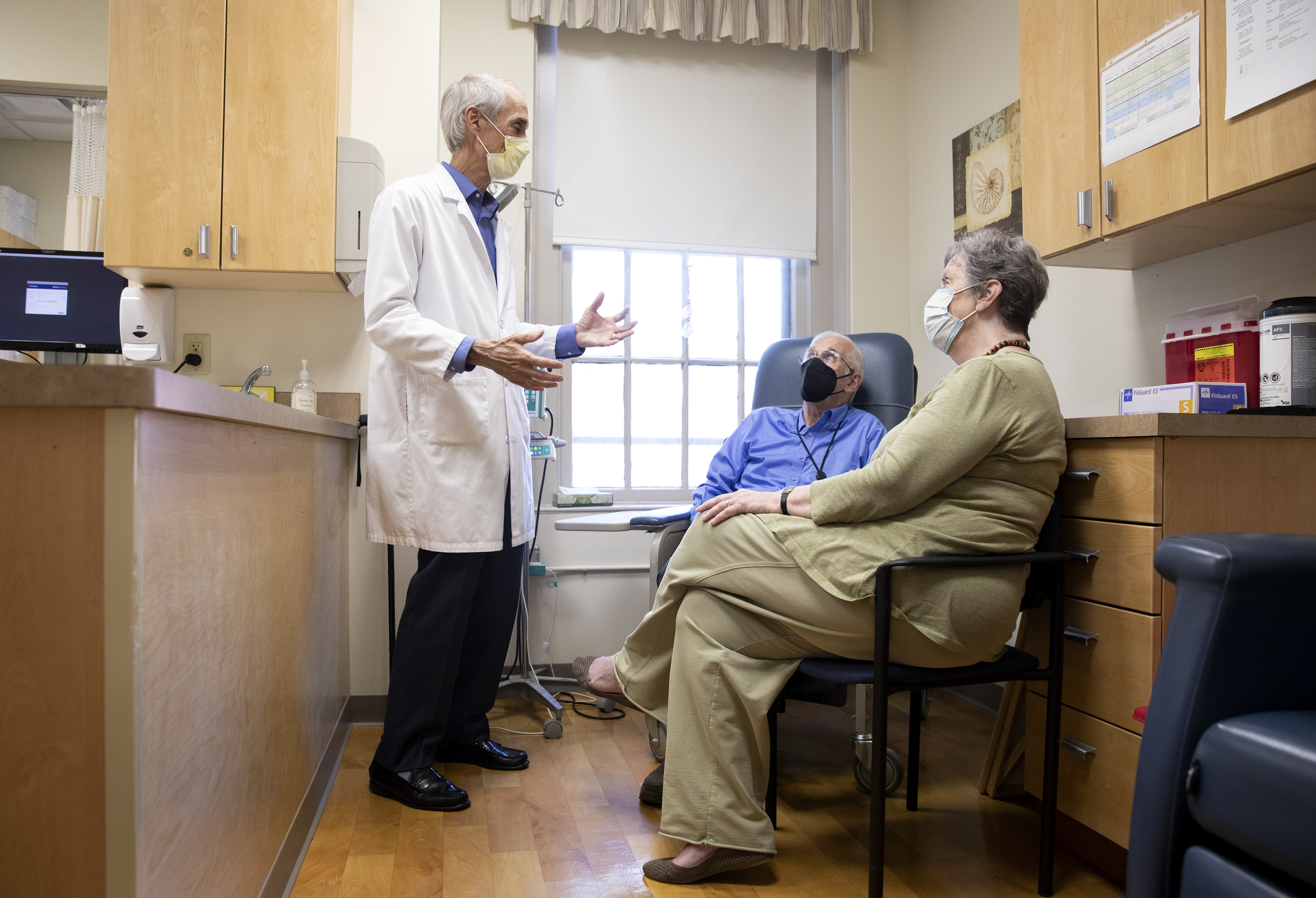
“Es una de las preguntas más difíciles que me han hecho”, dijo Koncilja. Los pacientes le preguntan cómo cambiarán sus vidas, a lo que comenta: “Y no sé qué responder”.
En las semanas transcurridas desde la decisión de la FDA, que no impone prácticamente ninguna reserva a la prescripción del medicamento, geriatras, neurólogos y otros médicos de todo Estados Unidos han respondido a preguntas similares.
Aduhelm ha generado una controversia intensa. Biogen detuvo dos ensayos en 2019 porque no demostraron ningún beneficio y luego presentó una solicitud a la FDA después de que un análisis posterior de un ensayo mostró un deterioro cognitivo un poco más lento en dosis elevadas.
En una carta dirigida a la FDA, la Sociedad Estadounidense de Geriatría argumentó que la aprobación era “prematura dada la falta de evidencia suficiente”. Más tarde, la Sociedad para la Medicina de Cuidados Posteriores y a Largo Plazo llegó a una conclusión similar.
El propio comité asesor de la FDA recomendó con insistencia que no se aprobara, y tres científicos miembros renunciaron en señal de protesta cuando la agencia hizo caso omiso de su consejo. Una nueva encuesta realizada a 200 neurólogos y médicos de atención primaria ha revelado que la mayoría no está de acuerdo con la decisión de la FDA.
La senadora demócrata Elizabeth Warren de Massachusetts y el senador republicano Bill Cassidy de Luisiana han solicitado una audiencia, ante su preocupación por la posibilidad de que el gasto de miles de millones de dólares en Aduhelm pueda perjudicar a Medicare. El Comité de Supervisión y Reforma de la Cámara de Representantes anunció una investigación sobre la aprobación y el precio del medicamento.
Teniendo en cuenta todo esto, ¿acaso los adultos mayores deberían considerar tomar Aduhelm?
“La FDA ha trasladado la determinación a la familia estadounidense”, señaló Jason Karlawish, codirector del Penn Memory Center, quien, junto con otros médicos, se opuso públicamente a la aprobación del fármaco.
Los médicos del Penn Memory también están recibiendo consultas de personas preocupadas. Geeta Simons, música de Filadelfia cuyo padre de 80 años padece alzhéimer, le envió un mensaje al neurólogo de su padre en ese centro.
Quería creer que esto era la salvación mágica”, dijo.
Estos médicos se enfrentan a “un dilema”, comentó Karlawish, “un momento en el que no hay una decisión que resuelva todas las incertidumbres y zanje las cuestiones éticas”.
“Nos pone en un dilema”, aseveró Karina Bishop, geriatra del Centro Médico de la Universidad de Nebraska. Desde el punto de vista ético, dijo: “Si este medicamento estuviera disponible ahora mismo, no me sentiría capaz de recetarlo”.
Incluso mientras los médicos luchan por aconsejar a los pacientes, los hospitales y los sistemas de salud están ideando protocolos para cuando Aduhelm esté disponible, quizá dentro de unas semanas.
En la Clínica Mayo, dijo Ronald Petersen, neurólogo que dirige el Centro de Investigación de la Enfermedad de Alzheimer, “vamos a ceñirnos bastante a los criterios de inclusión y exclusión utilizados en el ensayo”.
Eso significa que solo los pacientes con deterioro cognitivo leve o enfermedad de Alzheimer en fase inicial cumplirían los requisitos, después de una resonancia magnética para descartar ciertas afecciones y riesgos, así como de una tomografía por emisión de positrones (PET, por su sigla en inglés) o una punción lumbar para confirmar la presencia de amiloide. Los protocolos de la Clínica Mayo, al igual que los ensayos clínicos, excluirían a las personas que toman anticoagulantes como Warfarina o Eliquis.
“No es como si llegaras y dijeras: ‘Soy un poco olvidadizo’ y nosotros respondiéramos: ‘Toma este medicamento’”, dijo Petersen.
No obstante, reconoció que no todos los proveedores usarán estas medidas de seguridad.

Eric Widera, geriatra de la Universidad de California en San Francisco, expresó una preocupación similar: “Si los médicos fueran cautelosos en extremo y limitaran este fármaco a la población muy específica incluida en el estudio, con un seguimiento muy cuidadoso, sería la primera vez que se hiciera eso en medicina”.
Señaló otra consecuencia de la aprobación federal: un distanciamiento entre algunos médicos y la Asociación del Alzhéimer, el grupo nacional de defensa, que esta primavera montó una campaña que denominó More Time (Más Tiempo). La campaña, que pretendía demostrar el apoyo público a la aprobación del aducanumab, incluía publicaciones en los periódicos y en las redes sociales.
Ahora Widera, quien ha trabajado con una sección local para formar a estudiantes de medicina y residentes, busca una fuente de información alternativa a la cual pueda remitir a los pacientes. Ha llegado a desconfiar de la Asociación del Alzhéimer, al llamarla “una gran promotora, casi comercializadora, de Biogen”, la cual, al igual que otras empresas farmacéuticas, ayuda a financiar la organización y le aportó 275.000 dólares el año pasado.
La asociación dijo en un correo electrónico: “La historia nos ha demostrado que la aprobación del primer fármaco de una nueva categoría vigoriza el campo, aumenta las inversiones en nuevos tratamientos y genera una mayor innovación”.
Un importante factor imprevisible en el futuro de Aduhelm es la cobertura de los seguros. Medicare podría decidir autorizar la cobertura como “razonable y necesaria”, negarla o limitarla, o retrasar la decisión. Un portavoz de los Centros de Servicios de Medicare y Medicaid afirmó que estaba revisando la decisión de la FDA y que pronto tendría más información.
Dado el precio anunciado del medicamento, una política restrictiva de Medicare podría ponerlo fuera del alcance de la mayoría de los estadounidenses de edad avanzada.
Con el tiempo, la FDA también podría tomar medidas contra Aduhelm. Su proceso de “aprobación acelerada” requiere que Biogen realice un nuevo ensayo clínico; si este no muestra ningún beneficio, la agencia podría retirar la aprobación, pero Biogen tiene hasta 2030 para informar de esos resultados; para entonces, miles de pacientes esperanzados ya podrían estar tomando Aduhelm.
Por el momento, los médicos se debaten sobre cómo responder
“Uno de mis principios fundamentales es el respeto a la autonomía del paciente, en especial, en el caso de esta enfermedad, que degrada su capacidad de autodeterminación”, comentó Karlawish. Suavizó un poco su oposición al Aduhelm y dijo que ahora lo recetaría, tras amplias conversaciones con los pacientes, “pero lo haría con renuencia”.
Joan y James Morehouse, quienes esperan un tratamiento para el alzhéimer desde el diagnóstico de James hace cuatro años, en North Perry, Ohio, el 26 de junio de 2021. (Amber Ford/The New York Times)
Una fotografía de Joan y James Morehouse, tomada antes de que le diagnosticaran alzhéimer a James, en North Perry, Ohio, el 26 de junio de 2021. (Amber Ford/The New York Times)

